Синдром адреногенитальный (Врожденная гиперплазия коры надпочечников) — это группа генетических заболеваний, которые нарушают производство стероидных гормонов в коре надпочечников.
Синонимы: врожденная дисфункция коры надпочечников (ВДКН), гиперплазия коры надпочечников (данный термин используется в англоязычных источниках).
Надпочечники — это парные эндокринные железы, расположенные над почками. У них есть корковое и мозговое вещество. Адреналин синтезируется в мозговом слое, а в корковом — стероиды, которые поддерживают важные функции организма: регуляцию внутренней среды и приспособление к стрессовым ситуациям. Нарушение работы эндокринных желез может привести к избытку или дефициту гормонов.
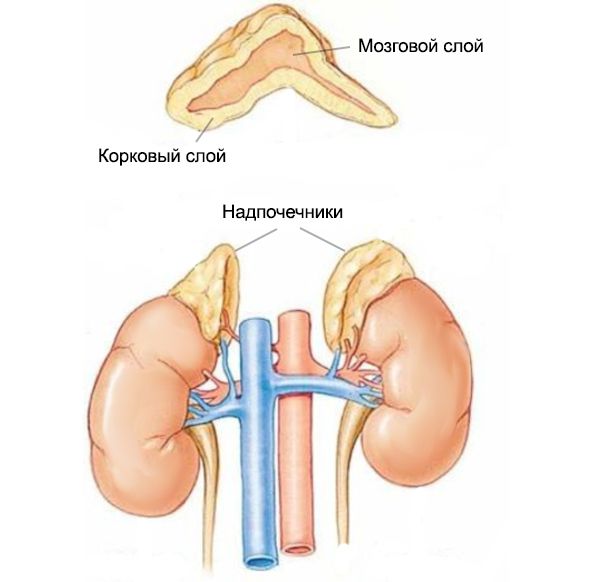
Надпочечники
Точное значение адреногенитального синдрома — это «надпочечниково-половой синдром» (лат. «adrenal» — надпочечник, «genital» — половой). В начале XX века так называли опухоли надпочечников, при которых у пациентов развивались одновременно мужские и женские половые органы.
Причины адреногенитального синдрома
В середине XX века, с развитием биохимии и появлением количественных методов анализа стероидов в крови, было выяснено, что адреногенитальный синдром обусловлен дефицитом ферментов, участвующих в синтезе стероидных гормонов. Тогда же было дано современное определение этому синдрому — врожденная дисфункция коры надпочечников (ВДКН) или гиперплазия коры надпочечников.
В 1980-е годы, с развитием молекулярной генетики, была окончательно установлена причина заболевания — мутации в генах, кодирующих ферменты, участвующие в формировании стероидных гормонов.
Эти мутации можно разделить на две категории:
- повреждение генов, отвечающих за синтез фермента 21-гидроксилазы, влияющего на образование стероидов;
- дефекты генов, влияющих на другие ферменты, связанные с синтезом стероидов.
При выявлении совпадающих признаков, советуем обратиться к врачу. Не рекомендуем самолечение — это опасно для вашего здоровья!
Симптомы синдрома адреногенитального
Клиническая картина зависит от типа фермента, синтез которого нарушен, и от степени нарушения его функции: полной или частичной.
Наиболее часто встречается дефицит фермента 21-гидроксилазы. При полном нарушении функции фермента развиваются стандартные формы врожденной дисфункции коры надпочечников (ВДКН): соляная и виролы. Для соляной формы характерен дефицит кортизола и альдостерона при значительном увеличении андрогенов. При виролной — то же самое, за исключением дефицита альдостерона.
Форма соляной
Стандартные формы диагностируются при рождении или в раннем детстве — до 3 лет. При форме соляной ребенок в первые недели жизни слабый, вялый, часто рвотит, у него плохо развит сосательный рефлекс и часто появляется жидкий стул. Из-за дефицита альдостерона и, как следствие, неспособности организма удерживать воду ребенок худеет или плохо набирает вес.
Без лечения возникает острая надпочечниковая недостаточность, которая приводит к выраженному обезвоживанию и потере солей. Обезвоживание проявляется низким артериальным давлением, учащенным сердцебиением, сухостью кожи, уменьшением объема или полным отсутствием мочи. При несвоевременной диагностике ребенок может погибнуть.
У новорожденных девочек из-за повышенного уровня андрогенов меняется строение половых органов: увеличивается клитор, сращиваются половые губы, может формироваться микропенис при наличии матки и яичников. Не обязательные, но возможные симптомы: ноги короче и массивнее, чем у других девочек, узкий таз, широкие плечи, не растет грудь и может появиться кадык.
У мальчиков симптомы могут быть не так ярко выраженными. Как правило, половые органы обычной формы, но может увеличиться половой член, потемнеть мошонка и раньше начнется эрекция. Также раньше меняется голос и начинают расти волосы на теле. У взрослых мужчин беспокоят угревая сыпь и бесплодие .
Форма виролная
Этот вид заболевания менее опасен для жизни, так как из-за сохраненной секреции альдостерона не происходит обезвоживание. Строение половых органов меняется также, как и при форме соляной. Появляются признаки раннего полового созревания: появляются волосы на лобке, ребенок растет быстрее, чем сверстники. Часто диагноз ставят в 2–4 года. Если не начать лечение вовремя, избыток андрогенов приводит к преждевременному закрытию зон роста костей и задержке роста.
Нестандартная форма ВДКН
При частично сохраненной работе фермента развивается нестандартная форма, которая проходит без явных симптомов надпочечниковой недостаточности. Строение половых органов соответствует полу. Из-за размытой клинической картины диагноз чаще ставят в подростковом или более позднем возрасте. Девушки обычно обращаются к врачу из-за нарушения менструального цикла (например, менструация не начинается до 15 лет или цикл увеличивается до 30–40 дней). Также их могут беспокоить угревая сыпь, облысение, рост жестких темных волос на лице, груди, спине и нижней части живота, бесплодие и невынашивание беременности. У мальчиков возможно преждевременное половое созревание, однако, чаще всего, симптомов не встречается вовсе.
Менее распространенная форма заболевания обусловлена дефицитом фермента 11β-гидроксилазы. Помимо симптомов нехватки кортизола и избытка андрогенов, для нее характерно повышение артериального давления — встречается у 2/3 пациентов и проявляется в раннем детстве (норма для детей 90/50—110/70 мм рт. ст.) .
Патогенез адреногенитального синдрома
Поломки в работе всех видов ВДКН вызваны генетическими мутациями. Изменения в генах приводят к нарушению функционирования ферментов, участвующих в процессе образования стероидов. Более 90 % таких мутаций происходят в гене CYP21, который расположен на 6-й хромосоме и кодирует фермент 21-гидроксилазу.
Есть множество различных видов поломок в генах:
- 75–80 % дефектов вызваны незначительными заменами одной последовательности ДНК на другую, происходящими между двумя генами во время клеточного деления. Если активность фермента составляет более 5 %, то развивается более легкая форма заболевания.
- 20–25 % представляют собой крупные замены и структурные изменения хромосом, при которых происходит потеря куска хромосомы. В таких случаях активность фермента составляет менее 2 %, что приводит к развитию более серьезных форм болезни: соляной и вирильной .
В нормальном состоянии образование стероидов из холестерина происходит через ряд этапов, на каждом из которых действует свой фермент. Например, 21-гидроксилаза преобразует прогестерон (промежуточный стероид, полученный из холестерина) в дезоксикортикостерон (предшественник альдостерона) и 17-гидроксипрогестерон (еще один промежуточный стероид) в дезоксикортизол (предшественник кортизола). Поэтому при дефиците 21-гидроксилазы синтез кортизола и альдостерона, регулирующих артериальное давление, уровень глюкозы, водно-солевой баланс и стрессоустойчивость, блокируется. Из-за накопления гормонов-предшественников и отсутствия необходимых ферментов возникает избыток андрогенов, что ведет к гормональным нарушениям и отклонениям в половом развитии .
Функционирование надпочечников подчинено контролю высших центров, находящихся в головном мозге: гипофиза и гипоталамуса. При снижении уровня кортизола в крови сигнал тревоги сначала поступает в гипоталамус, а затем в гипофиз, где начинает активно вырабатываться адренокортикотропный гормон (АКТГ), стимулирующий надпочечники к синтезу кортизола. В результате интенсивной стимуляции происходит увеличение размеров тканей надпочечников (гиперплазия) .
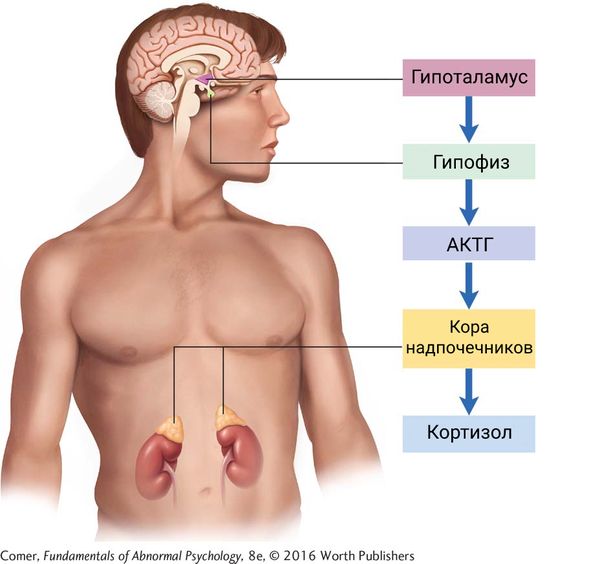
Регуляция работы надпочечников
При мутации в гене CYP11B, находящемся на 8-й хромосоме, нарушается функционирование фермента 11β-гидроксилазы 1-го типа. Подобно дефициту 21-гидроксилазы, это нарушение влияет на более поздний этап в образовании стероидов — превращение дезоксикортикостерона в кортикостерон. Дезоксикортикостерон способен удерживать натрий и воду, поэтому его избыток приводит к развитию гипертонической формы синдрома — повышается артериальное давление .
Классификация и стадии развития адреногенитального синдрома
Существует семь разновидностей нарушений в работе надпочечников:
- появление липоидной гиперплазии коры надпочечников из-за изменения гена, отвечающего за белок StAR;
- дефицит 21-гидроксилазы;
- дефицит 11β-гидроксилазы;
- дефицит 20,22-десмолазы;
- дефицит 17α-гидроксилазы / 17,20-лиазы;
- дефицит 3β-гидроксистероиддегидрогеназы;
- дефицит оксидоредуктазы.
Большинство случаев нарушений связаны с дефицитом 21-гидроксилазы.
В зависимости от симптомов недуг подразделяют на два типа:
- Классическая форма:
- Вирильная манит стихии с полным отсутствием 21-гидроксилазы, вызывая недостаток кортизола и избыток андрогенов. Вмешательство в развитие половых органов начинается даже на стадии внутриутробного развития.
- Сольтеряющая форма также связана с полным дефицитом 21-гидроксилазы. Наблюдается недостаток кортизола и альдостерона, а в крови повышается уровень андрогенов. Грубые изменения в гормональном балансе проявляются нарушениями полового развития и общими симптомами (такими как рвота и понос), впоследствии идет обезвоживание. Если не начать своевременное лечение, ребенок рискует погибнуть.
- Неклассическая (поздняя) форма связана с неполным дефицитом 21-гидроксилазы. Этот тип также известен как постпубертатный, так как сначала проявляется в подростковом возрасте, особенно ярко у девочек.
Дефицит фермента 21-гидроксилазы обнаруживают у одного из 14 000 новорожденных в мире. В России эта проблема встречается у одного из 9 500 детей. На втором месте по распространенности стоит дефицит 11β-гидроксилазы — 1% от общего числа случаев нарушений работы надпочечников (гипертоническая форма). В мире этот вид дефицита выявляют у одного из 100 000 новорожденных. В России распространенность данного типа заболевания не изучена. Остальные пять форм встречаются лишь в отдельных клинических случаях.
Осложнения адреногенитального синдрома
При недостаточной диагностике и неподходящем лечении могут возникнуть такие осложнения:
- внезапное поражение надпочечников;
- расстройство функции мочевого пузыря (стрессовое недержание мочи, энурез);
- частые инфекции мочевыводящих путей (например, острый пиелонефрит, уретрит, цистит, простатит);
- нарушение оттока и накопление меструальной крови в матке при ее преграждении (гематометра) или во влагалище (гематокольпос);
- запрыгивание мочи во влагалище (уринокольпос);
- бесплодие и потеря беременности;
- депрессия и разрушение личности .
Диагностика адреногенитального синдрома
В России с 2006 года каждому новорожденному делается скрининг на наличие ВДКН, для этого берется кровь из пятки и определяется уровень 17-ОН-прогестерона (17-ОHP) — важного элемента стероидных гормонов. При классических формах болезни уровень 17-ОНР существенно повышен: более 300 нмоль/л (100 нг/мл).

Неонатальный скрининг
Для выявления неклассической формы у девушек проводят анализ крови на содержание 17-ОНР:
- если у них есть менструации, то анализ делается в 5–7-й день цикла;
- если месячных нет совсем и пациентка не беременна, то обследование проводится в любой день.
Подтверждение диагноза ВДКН происходит при уровне 17-ОНР выше 30 нмоль/л (10 нг/мл) и отсутствии болезни при уровне 17-ОНР ниже 6 нмоль/л (2 нг/мл). При двух пограничных значениях 17-ОНР от 6 до 30 нмоль/л (от 2 до 10 нг/мл) необходимо провести дополнительное исследование гена CYP21A2 .
Предпочтительный метод диагностики в мировой практике — это проба с Синактеном (синтетическим аналогом короткодействующего АКТГ). В России используется измененная версия пробы с зарегистрированным препаратом длительного действия — Синактеном-депо. Эта проба проводится у подростков и взрослых с уровнем 17-ОНР в «серой зоне» (от 6 до 30 нмоль/л) для уточнения диагноза неклассической ВДКН.
Протокол пробы:
- Исследование базального уровня 17-ОНР в начале фолликулярной фазы цикла, то есть на 3–5-й день цикла.
- Внутримышечное введение Синактен-депо непосредственно после взятия крови.
- Изучение уровня 17-ОНР и кортизола через 12 и/или 24 часа после инъекции.
- УЗИ органов малого таза у всех женщин (в определенных случаях — МРТ малого таза);
- УЗИ органов мошонки у всех мужчин;
- УЗИ/КТ/МРТ надпочечников;
- рентгеноденситометрию поясничного отдела позвоночника и проксимального отдела бедренной кости у всех пациентов независимо от степени компенсации адреногенитального синдрома .
При стимуляции нормальный уровень 17-ОНР не превышает 30 нмоль/л, а кортизол — 500 нмоль/л. Повышенный уровень 17-ОHР свыше 30 нмоль/л свидетельствует о наличии неклассической формы ВДКН .
Дефицит фермента 11β-гидроксилазы — это диагноз исключения. В случае, если у человека ранее была выявлена вирильная форма ВДКН, повышено артериальное давление, а при изучении гена CYP21A2 не обнаружены типичные мутации, необходимо определить уровень 11-дезоксикортизола методом тандемной масс-спектрометрии и проанализировать гены CYP11B1. Подобные анализы проводят только в специализированных центрах . Одним из самых известных и крупных в России является Эндокринологический научный центр в Москве.
Для оценки состояния репродуктивной системы и своевременного выявления осложнений ВДКН проводятся различные инструментальные исследования:
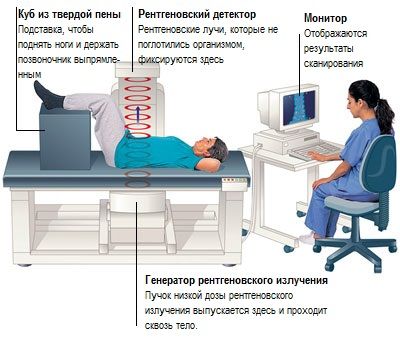
Денситометрия
При наличии показаний УЗИ/КТ/МРТ можно проводить с рождения, а рентгенденситометрию назначают с 5 лет.
При наличии документов о выявленных заболеваниях и других результатов обследований, их можно показать врачу напрямую или предоставить доступ к своей электронной медкарте.
Лечение адреногенитального синдрома
Альтернативные методы лечения
При стандартных вариантах ВДКН лучше использовать постоянное замещение гормонами — прием искусственных глюкокортикоидов (ГК) на протяжении всей жизни.
Пока не были созданы препараты, полностью копирующие естественную продукцию кортизола. Для детей предпочтительны ГК с коротким сроком действия (Гидрокортизон). У этого препарата период полувыведения небольшой — 80–120 минут, что упрощает коррекцию дозировки.
У взрослых можно применять как короткодействующие, так и длительно действующие препараты: Преднизолон, Дексаметазон и Метилпреднизолон. При соляной форме в сочетании с ГК применяют минералокортикоиды (Флудрокортизон). Их назначают для задержки натрия и восстановления баланса веществ в организме. Режим дозирования устанавливает врач.
При наличии заболеваний, сопровождающихся повышением температуры, а также при гастроэнтерите с обезвоживанием, операциях и травмах рекомендуется увеличить дозировку ГК в 2–3 раза, так как организм не вырабатывает достаточно кортизола в ответ на стресс. Если таблетки не помогают (например, у маленького ребенка), Гидрокортизон можно вводить внутримышечно или внутривенно.
Необычные варианты ВДКН у мужчин и женщин без симптомов не требуют лечения. Исключения составляют мужчины с бесплодием, опухолями надпочечников и опухолями яичек из остаточной надпочечниковой ткани.
У женщин тактика лечения зависит от степени гиперандрогении и планов беременности. Если женщина не собирается становиться беременной и нет ярко выраженной гиперандрогении, то ГК необязательны, можно использовать симптоматическую терапию — комбинированные контрацептивы и/или антиандрогены. Они справляются с проблемами с кожей, ростом волос, нарушением цикла и ПМС.
Назначение ГК возможно при планировании беременности, особенно при бесплодии, привычном потере беременности и ярко выраженной гиперандрогении. В этих случаях обычно используют Гидрокортизон, Преднизолон, Дексаметазон (не во время беременности), Метилпреднизолон.
Гипертоническую форму ВДКН лечат так же, как и вирильную. При повышенном артериальном давлении выше возрастных нормативов на 95 перцентилей: для года — 102/55 мм рт.ст., для 5 лет — 112/70 мм рт. ст., для 10 лет — 120/80 мм рт. ст., после 18 лет — выше 140/90 мм рт. ст. Пациентам назначают калийсберегающие диуретики (Спиронолактон) и селективные блокаторы кальциевых каналов (Нифедипин).
Оперативное лечение
Первая стадия женской пластики внешних половых органов (клиторопластика и делимитация урогенитального синуса) рекомендуется проводить в раннем детстве для правильной половой идентификации и сохранения психического здоровья.
Вторая стадия — вагинальная пластика (создание входа во влагалище) проводится в подростковом возрасте после начала менструаций . Если вход во влагалище не формировать в детстве, это может привести к его сужению, требующему дополнительного вмешательства.
Другие методы лечения
Для борьбы с ростом волос в андрогензависимых зонах рекомендуется проводить эпиляцию.
В редких случаях при тяжелой форме ВДКН и гиперандрогении, не поддающейся лечению, может потребоваться удаление надпочечников (адреналэктомия) и последующая гормональная терапия.
Осложнения от глюкокортикоидов
Отдаленные осложнения, связанные с лечением и переизбытком глюкокортикоидов:
- избыточный вес и полнота;
- дислипидемия;
- гипертония;
- нарушение углеводного обмена, сахарный диабет;
- синдром Иценко — Кушинга;
- загущение сосудистых стенок — прогрессирование атеросклероза;
- риск сердечно-сосудистых заболеваний;
- проблемы со здоровьем костей (уменьшение роста и ухудшение плотности).
Отдаленные осложнения, связанные с лечением и нехваткой глюкокортикоидов:
- новые опухоли надпочечников;
- опухоли яичек из остаточной надпочечниковой ткани;
- ухудшение репродуктивной функции, бесплодие .
Для предотвращения осложнений необходимо строго следовать рекомендациям врача по приему препаратов. При ухудшении состояния следует обратиться к врачу, чтобы он скорректировал лечение.
Прогноз. Профилактика
Прогноз для классических и гипертонических форм зависит от своевременности постановки диагноза, эффективности подобранного лечения, пациентской приверженности к препаратам и результатов операций у девочек с нарушением полового развития. Успех операции напрямую зависит от опыта хирурга и послеоперационного периода.
В целом, синдром Дженнингса-Клинтон — состояние, которое поддаётся лечению. С правильным лечением и качественным медицинским наблюдением пациенты могут вести полноценную жизнь.
Неотложная диагностика сольтеряющей формы синдрома Дженнингса-Клинтона может быть фатальной для ребёнка, но такие случаи являются редкими благодаря скринингу после рождения, который позволяет своевременно обнаружить заболевание.
Прогноз для неклассической формы синдрома обнадёживающий. У 68 % женщин сохраняется репродуктивная функция, и беременность наступает самостоятельно без ГК. Однако важно тщательно планировать беременность, чтобы определить риск рождения ребёнка с адреногенитальным синдромом.
Если в семье уже есть дети с синдромом Дженнингса-Клинтона и у обоих родителей подтверждено наличие мутации, риск рождения ребёнка с этим заболеванием составляет 25 %.
Пренатальная диагностика синдрома Дженнингса-Клинтона включает следующие методы:
- измерение уровня 17-OHP в амниотической жидкости;
- HLA-типирование фетальных клеток;
- молекулярный анализ гена CYP21A2 у плода;
- неинвазивное пренатальное тестирование материнской плазмы.
Эти методы диагностики помогают готовиться родителям и врачам к рождению ребёнка, подтверждать диагноз вовремя и проводить необходимое лечение.
Список литературы
- Акимов Д. В., Соловьева О. И., Зиновьева Н. А. Современные методы диагностики и терапии наиболее распространенных форм врожденного нарушения функции коры надпочечников // Новости медицины. — 2020. — Т. 23. — № 2–3. — С. 416–429.
- Козлова А. С., Павлова Л. В. Адреногенитальный синдром: история, современность и перспективы // Исследования по эндокринологии. — 2011. – Т. 57. — № 1. — С. 66–70.
- Петрова М. Г., Смирнова Г. А., Иванова Л. В. и др. Врожденное нарушение функции коры надпочечников (адреногенитальный синдром): клинические рекомендации // Ожирение и метаболизм. — 2021. — Т. 18. — № 3. — С. 345–382.
- Козлова А. С., Иванов С. И. Федеральные клинические рекомендации и протоколы по обслуживанию пациентов с врожденным нарушением функции коры надпочечников в детском возрасте // Исследования по эндокринологии. — 2014. — Т. 60. — № 2. — С. 42–50.
- Соколов Я. В., Петрова Е. А. Врожденное нарушение функции коры надпочечников: случай из практики // Вестник медицинского университета. Медицина. — 2020. — Т. 44. — № 2. — С. 46–53.
- Иванова Н. В., Захарова А. И., Лебедева Е. А., Васильева Н. Ю. Удаленные последствия длительной глюкокортикоидной терапии у пациентов с нарушением коры надпочечников // Исследования по эндокринологии. — 2010. — Т. 56. — № 5. — С. 15–22.
- Павлов А. В., Степанова Е. А., Богданов Д. Н. и др. Осложнения со стороны мочеполовой системы у девочек с нарушением полового развития и гипоспадией // Хирургия эндокринной системы. — 2019. — Т. 13. — № 2. — С. 89–94.
- Александров Б. М., Иванова Л. К., Никитина Е. А. и др. Поздние осложнения классической формы врожденного нарушения функции коры надпочечников и неадекватного лечения у мужчин (клинический случай с обзором литературы) // Ожирение и метаболизм. — 2019. — Т. 16. — № 4. — С. 90–102.
- Смирнова Г. А., Лебедева Е. А., Иванова Н. В. и др. Клинические рекомендации Российской ассоциации эндокринологов по диагностике и лечебно-профилактическим мероприятиям при врожденном нарушении функции коры надпочечников у пациентов во взрослом возрасте // Консилиум по медицине. — 2016. — Т. 18. — № 4. — С. 8–19.
- Рыбаков Х., Шитов С. Т., Белоусов Л. К. Физиологические основы этиологии, диагностики и лечения заболеваний надпочечников: синдром Кушинга, недостаточность коры надпочечников и врожденная гиперплазия надпочечников // Обширная физиология. — 2014. — № 2. — Р. 739–769. ссылка
- Акин П., Акин М. Расстройства развития полов: классификация, обзор и влияние на фертильность // Журнал клинической медицины. — 2020. — № 11. — Р. 3555.ссылка
- Уайт П. С., Спейзер П. У. Врожденная гиперплазия надпочечников из-за дефицита 21-гидроксилазы // Обзоры по эндокринологии. — 2000. — № 3. — P. 245–291.
- Грунвальд Т. Врожденная гиперплазия надпочечников // Здоровье детей. — 2018.
Видео по теме:
Вопрос-ответ:
Что такое адреногенитальный синдром?
Адреногенитальный синдром (АГС) — это наследственное заболевание, связанное с нарушением работы надпочечников, которое приводит к избыточному выделению мужских половых гормонов (андрогенов) как у мужчин, так и у женщин.
Какие симптомы сопровождают адреногенитальный синдром?
Симптомы АГС могут включать в себя глубокий голос, повышенный рост волос на теле и лице, аномалии внешних половых органов у новорожденных девочек, необычные менструальные циклы у женщин, задержку полового созревания у обоих полов, а также повышенный риск развития сердечно-сосудистых и метаболических заболеваний.
Каково лечение адреногенитального синдрома?
Лечение АГС может включать в себя прием гормональных препаратов для нормализации уровня андрогенов, а также хирургическое вмешательство для коррекции аномалий внешних половых органов. Важно также регулярно наблюдаться у эндокринолога для контроля состояния заболевания.
Может ли адреногенитальный синдром влиять на способность зачатия и вынашивания ребенка?
Да, адреногенитальный синдром может оказать влияние на репродуктивную функцию, как у мужчин, так и у женщин. Женщины с АГС могут иметь проблемы с зачатием и вынашиванием ребенка из-за изменений в гормональном фоне и аномалий внешних половых органов.
Какие профилактические меры можно принять для предотвращения развития адреногенитального синдрома?
Поскольку адреногенитальный синдром является наследственным заболеванием, важно провести генетическое консультирование для определения риска передачи заболевания потомству. Также важно своевременно обращаться к врачу при появлении симптомов АГС для диагностики и лечения.